La hemoglobina (Hb) es una metaloproteína que contiene hierro y que se encuentra abundantemente en los glóbulos rojos de prácticamente todos los vertebrados. A menudo se la considera la "molécula vital" por su papel indispensable en la respiración. Esta compleja proteína es responsable de la crucial tarea de transportar oxígeno desde los pulmones a todos los tejidos del cuerpo y facilitar el retorno del dióxido de carbono para su excreción. Comprender su función, los sofisticados mecanismos que rigen su comportamiento y la importancia fundamental de su medición clínica ofrece una perspectiva sobre la salud y la enfermedad humanas.
Función y mecanismo: una obra maestra de la ingeniería molecular
La función principal de la hemoglobina es el transporte de gases. Sin embargo, no realiza esta función como una simple esponja pasiva. Su eficiencia se debe a un diseño estructural sofisticado y a mecanismos reguladores dinámicos.
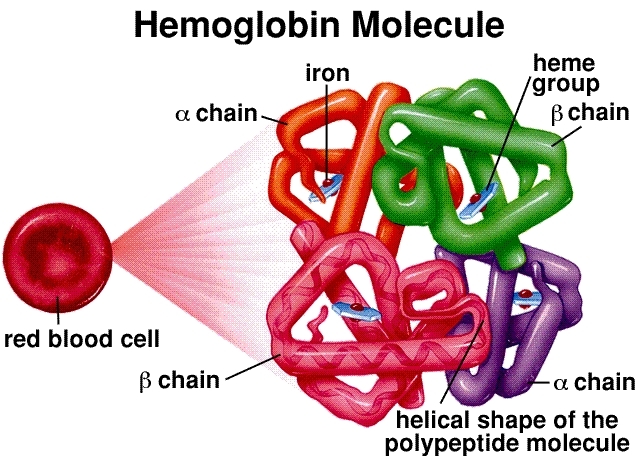
Estructura molecular: La hemoglobina es un tetrámero, compuesto por cuatro cadenas de proteína globina (dos alfa y dos beta en adultos). Cada cadena está asociada a un grupo hemo, una estructura anular compleja con un átomo central de hierro (Fe²⁺). Este átomo de hierro es el sitio de unión de una molécula de oxígeno (O₂). Por lo tanto, una sola molécula de hemoglobina puede transportar un máximo de cuatro moléculas de oxígeno.
Unión Cooperativa y Curva Sigmoidea: Esta es la piedra angular de la eficiencia de la hemoglobina. Cuando la primera molécula de oxígeno se une a un grupo hemo en los pulmones (donde la concentración de oxígeno es alta), induce un cambio conformacional en toda la estructura de la hemoglobina. Este cambio facilita la unión de las dos moléculas de oxígeno subsiguientes. La cuarta molécula de oxígeno final se une con la mayor facilidad. Esta interacción "cooperativa" da lugar a la característica curva de disociación del oxígeno sigmoidea (en forma de S). Esta forma de S es crucial, ya que significa que, en el entorno rico en oxígeno de los pulmones, la hemoglobina se satura rápidamente, pero en los tejidos pobres en oxígeno, puede liberar una gran cantidad de oxígeno con solo una pequeña caída de presión.
Regulación alostérica: La afinidad de la hemoglobina por el oxígeno no es fija; se regula con precisión según las necesidades metabólicas de los tejidos. Esto se logra mediante efectores alostéricos:
El efecto Bohr: En los tejidos activos, la alta actividad metabólica produce dióxido de carbono (CO₂) y ácido (iones H⁺). La hemoglobina detecta este entorno químico y responde disminuyendo su afinidad por el oxígeno, lo que provoca una liberación más abundante de O₂ justo donde más se necesita.
2,3-Bisfosfoglicerato (2,3-BPG): Este compuesto, producido en los glóbulos rojos, se une a la hemoglobina y estabiliza su estado desoxigenado, lo que favorece la liberación de oxígeno. Los niveles de 2,3-BPG aumentan en condiciones de hipoxia crónica, como en altitudes elevadas, para mejorar el aporte de oxígeno.
Transporte de dióxido de carbono: La hemoglobina también desempeña un papel vital en el transporte de CO₂. Una pequeña pero significativa porción de CO₂ se une directamente a las cadenas de globina, formando carbaminohemoglobina. Además, al amortiguar los iones H⁺, la hemoglobina facilita el transporte de la mayor parte del CO₂ en forma de bicarbonato (HCO₃⁻) en el plasma.
La importancia crítica de las pruebas de hemoglobina
Dado el papel central de la hemoglobina, medir su concentración y evaluar su calidad es un pilar fundamental de la medicina moderna. La prueba de hemoglobina, que a menudo forma parte de un hemograma completo (HC), es una de las pruebas clínicas más solicitadas. Su importancia es fundamental por las siguientes razones:
Monitoreo de la progresión de la enfermedad y el tratamiento:
Para los pacientes diagnosticados con anemia, las mediciones seriadas de hemoglobina son esenciales para monitorear la efectividad del tratamiento, como la suplementación con hierro, y para seguir la progresión de enfermedades crónicas subyacentes como insuficiencia renal o cáncer.
Detección de hemoglobinopatías:
Las pruebas especializadas de hemoglobina, como la electroforesis de hemoglobina, se utilizan para diagnosticar trastornos genéticos hereditarios que afectan la estructura o la producción de hemoglobina. Los ejemplos más comunes son la anemia de células falciformes (causada por una variante defectuosa de la HbS) y la talasemia. La detección temprana es vital para el tratamiento y el asesoramiento genético.
Evaluación de la policitemia:
Un nivel anormalmente alto de hemoglobina puede indicar policitemia, una afección en la que el cuerpo produce un exceso de glóbulos rojos. Esto puede ser un trastorno primario de la médula ósea o una respuesta secundaria a la hipoxia crónica (p. ej., en enfermedades pulmonares o a grandes altitudes), y conlleva riesgo de trombosis.
Detección y evaluación general de la salud: La prueba de hemoglobina es una parte rutinaria de la atención prenatal, los chequeos prequirúrgicos y los exámenes generales de bienestar. Sirve como un indicador general del estado de salud y nutricional.
Manejo de la diabetes: Si bien no es la hemoglobina estándar, la prueba de hemoglobina glucosilada (HbA1c) mide la cantidad de glucosa adherida a la hemoglobina. Refleja los niveles promedio de azúcar en sangre de los últimos 2 a 3 meses y es el estándar de oro para el control glucémico a largo plazo en pacientes diabéticos.
Conclusión
La hemoglobina es mucho más que un simple transportador de oxígeno. Es una máquina molecular de exquisito diseño que emplea la unión cooperativa y la regulación alostérica para optimizar el suministro de oxígeno en respuesta a las necesidades dinámicas del cuerpo. Por consiguiente, la medición clínica de la hemoglobina no es solo un número en un informe de laboratorio; es una potente herramienta de diagnóstico y monitorización no invasiva. Proporciona una visión general indispensable de la salud hematológica y general de una persona, lo que permite el diagnóstico de enfermedades que alteran la vida, el seguimiento de enfermedades crónicas y la preservación de la salud pública. Comprender tanto su ingenio biológico como su importancia clínica subraya por qué esta humilde proteína sigue siendo una piedra angular de la ciencia fisiológica y médica.
Hora de publicación: 17 de octubre de 2025